
雜志:Journal of Experimental & Clinical Cancer Research
影響因子: 11.3(2022)
年份:2017
通訊作者: Ming-Fang He
通訊作者單位:Institute of Translational Medicine, College of Biotechnology and Pharmaceutical Engineering, Nanjing Tech University
摘要:
背景: 胃癌(GC)是亞洲最常見的贴届、尤其是在中國高發(fā)的癌癥之一靠粪。由于其高異質(zhì)性和很少的已驗證的藥物靶點,GC仍然是精確醫(yī)學(xué)中最缺乏探索的領(lǐng)域之一毫蚓。在這項研究中占键,我們的目的是建立一個基于斑馬魚(Danio rerio)胚胎的體內(nèi)患者來源的異種移植物(PDX)模型,快速分析GC對血管生成影響和癌癥侵襲性的能力元潘,以及快速的藥物敏感性測試畔乙。
方法:將兩種人胃癌細胞系(AGS和SGC-7901)異種移植到斑馬魚胚胎中,并在體外和體內(nèi)檢測了它們對5-FU的敏感性翩概。將14個來自胃癌組織的人原代細胞移植到斑馬魚胚胎中牲距,并在體內(nèi)評估了它們的增殖、血管生成和轉(zhuǎn)移活性氮帐。對4例患者的主要樣本也檢測了對5-FU嗅虏、多西他賽和阿帕替尼的敏感性。
結(jié)果:SGC-7901在體外和體內(nèi)對5-FU的敏感性均高于AGS上沐。14個患者樣本中有9個被成功移植到斑馬魚胚胎中皮服,所有這些樣本在活胚胎中均顯示出增殖、血管生成和轉(zhuǎn)移潛能参咙。4例患者對所選三種化療藥物的敏感性不同龄广。
結(jié)論:我們的斑馬魚PDX(zPDX)模型是一種臨床前可靠的胃癌體內(nèi)模型。zPDX模型也是胃癌的轉(zhuǎn)化研究和個性化治療的理想平臺蕴侧。
關(guān)鍵詞:胃癌择同,斑馬魚,患者來源的異種移植物净宵,顯微注射敲才,轉(zhuǎn)化研究
前言
胃癌(GC)仍然是全球范圍內(nèi)的一個主要的健康負擔。根據(jù)國際癌癥研究機構(gòu)(IARC)2012年的統(tǒng)計數(shù)據(jù)择葡,胃癌是全球第五大最常見的惡性腫瘤紧武,也是第三大癌癥死亡原因。70%以上的病例發(fā)生在發(fā)展中國家敏储,其中一半的世界總病例發(fā)生在東亞(主要發(fā)生在中國)阻星。根據(jù)中國國家癌癥預(yù)防控制辦公室統(tǒng)計,GC分別是男性和女性中第二和第三位已添,是男女癌癥死亡的第二大原因妥箕。
在中國滥酥,近90%的患者被診斷為晚期胃癌。雖然近年來靶向藥物的加入在一定程度上改善了預(yù)后畦幢,但基于含氟尿嘧啶化療的綜合治療仍是晚期胃癌的主要策略坎吻。晚期的GC患者的中位生存率仍不到12個月,整體5年生存率低至只有20%呛讲。 造成這些的原因是由于胃癌的化學(xué)敏感性或化療耐藥性造成的高異質(zhì)性質(zhì)和其他未知機制禾怠。因此,新藥的開發(fā)以及當前藥物的個性化治療策略的建立成為主要挑戰(zhàn)贝搁。
近年來,患者來源的異種移植(PDX)模型越來越流行芽偏,比細胞系來源的異種移植(CDX)模型具有更大的優(yōu)勢雷逆。它緊密地再現(xiàn)了患者原發(fā)腫瘤的異質(zhì)性,并具有基因表達和突變狀態(tài)的生物學(xué)穩(wěn)定性污尉。越來越多的證據(jù)表明膀哲,PDX模型通過直接比較患者及其相應(yīng)的異種移植物的藥物反應(yīng),忠實地再現(xiàn)了患者的腫瘤生物學(xué)被碗,并預(yù)測了患者的藥物反應(yīng)某宪。目前,大多數(shù)PDX模型都是通過將患者的腫瘤組織皮下移植到NOD/SCID(非肥胖糖尿病/嚴重聯(lián)合免疫缺陷)小鼠中而建立的锐朴。目前已經(jīng)建立了各種腫瘤的小鼠PDX模型兴喂,包括結(jié)直腸癌、乳腺癌]焚志、非小細胞肺癌衣迷、腎細胞癌和胃癌,用于腫瘤生物學(xué)和藥物篩選的研究酱酬。然而壶谒,相關(guān)的成本是巨大的,而且完成這些研究所需的時間可能是廣泛的膳沽,并且與在可操作的時間框架內(nèi)的患者導(dǎo)向干預(yù)不兼容汗菜。
斑馬魚(Danio rerio)是一種強大的、基因可控的人類惡性腫瘤研究模型挑社。它顯示了與哺乳動物高度的生理和遺傳相似性陨界,接近臨床環(huán)境,并允許腫瘤的自然生長監(jiān)測滔灶。由于其胚胎具有明顯透明的特點普碎,可在體內(nèi)便捷地管子腫瘤的發(fā)展、血管生成录平、侵襲和轉(zhuǎn)移麻车,使其成為一種很有前途的異種移植腫瘤模型缀皱。近年來,斑馬魚PDX(zPDX)模型的價值剛剛出現(xiàn)了动猬。
本文的目的是描述一種新的GC的體內(nèi)zPDX模型啤斗。該模型可用于以節(jié)省時間和成本的研究腫瘤血管生成、細胞侵襲性和藥物反應(yīng)赁咙。重要的是钮莲,這項工作揭示了zPDX模型,作為第一個個性化GC治療的實時體內(nèi)平臺彼水。
方法
試劑
5-氟尿嘧啶(5-FU崔拥,純度≥98%)購買自西格瑪奧爾德里奇(美國圣盧里斯)和溶解在胚胎培養(yǎng)基或細胞培養(yǎng)基獲得母液5M濃度。多西他賽(純度≥98%)和阿帕替尼(純度≥98%)購買自MERYER(中國上海)和溶解在DMSO獲得母液濃度分別為5mM和500 μM凤覆。胎牛血清(FBS)链瓦、磷酸鹽緩沖鹽水(PBS)、羅斯威爾帕克紀念研究所基礎(chǔ)培養(yǎng)基1640(RPMI 1640)盯桦、青霉素和鏈霉素均購自基礎(chǔ)培養(yǎng)基技術(shù)公司(上海慈俯,中國)。
斑馬魚的養(yǎng)殖和處理
在內(nèi)皮細胞中表達增強綠色熒光蛋白(EGFP)的轉(zhuǎn)基因斑馬魚Tg(fli-1:EGFP)來自南京大學(xué)模型動物研究中心拥峦。它們被養(yǎng)殖在28.5°C贴膘。光-暗周期為14:10小時。胚胎是將2只雄性和2只雌性混合在配有網(wǎng)格的水箱中略号,以避免對新產(chǎn)卵的捕食刑峡。魚在光照的刺激下進行交配和產(chǎn)卵。收集胚胎璃哟,以28.5°C放置于含有胚胎培養(yǎng)基(0.2 g/L蒸餾水中速溶海洋?Salt)的培養(yǎng)皿中氛琢。胚胎的年齡以受精后數(shù)小時(hpf)表示。對斑馬魚的研究得到了南京科技大學(xué)動物護理和使用委員會(IACUC)的批準随闪。
細胞系培養(yǎng)和原代組織分離
GC細胞系A(chǔ)GS和SGC-7901(ATCC阳似,Rockville,MD铐伴,USA)在RPMI 1640中添加10%胎牛血清和100 U/mL青霉素和鏈霉素撮奏。2016年9月至2017年8月,胃癌樣本經(jīng)南京醫(yī)科大學(xué)患者知情同意和機構(gòu)倫理委員會批準后当宴,來自南京醫(yī)科大學(xué)第一附屬醫(yī)院普外科胃腸外科(注冊人數(shù)10,092例)畜吊。包含人類受試者的研究是根據(jù)《世界醫(yī)學(xué)協(xié)會道德守則》(《赫爾辛基宣言》)進行的。所有患者在手術(shù)切除前均未接受放療或化療户矢。切除后玲献,組織樣本直接轉(zhuǎn)移到預(yù)冷的組織存儲溶液(米特尼,貝吉施格拉德巴赫,德國)捌年。根據(jù)制造商的說明瓢娜,通過腫瘤分離試劑盒(德國貝爾吉施格拉德巴赫)從組織樣本中分離原代單細胞。
體外細胞活力試驗
使用細胞計數(shù)試劑盒-8(CCK-8礼预,Dojindo眠砾,日本)測定細胞活力。將對數(shù)期的細胞接種于96孔板(3×103細胞/孔)托酸,過夜培養(yǎng)后褒颈,將培養(yǎng)基替換為含有指定濃度的5-FU的新鮮培養(yǎng)基(150μl/孔),培養(yǎng)72小時励堡。用培養(yǎng)基處理過的細胞作為載體對照谷丸。隨后,每孔加入10 μl CCK8溶液应结,細胞孵育2h后淤井, 使用酶標儀(BioTek,維諾斯基摊趾,VT,美國)測量在450 nm處吸光度游两。對照組的吸光度被視為100%的細胞活力砾层。結(jié)果以吸光度形式的抑制百分比表示。采用GraphPad Prism 5.0分析50%抑制濃度(半抑制濃度)贱案。所有實驗均重復(fù)3次肛炮,獨立實驗至少重復(fù)4次。
細胞標記宝踪,異種移植和計數(shù)過程
細胞系A(chǔ)GS和SGC-7901和原代GC細胞根據(jù)制造商的說明用CM-DiI(Invitrogen侨糟,生命技術(shù)公司,卡爾斯巴德瘩燥,CA秕重,美國)進行熒光標記。標記細胞用PBS洗滌兩次厉膀,在添加10%胎牛血清的RPMI1640中重新懸浮溶耘,濃度為2×107個細胞/ml。注射前用臺盼藍染色法檢測細胞活力服鹅。GC細胞系的細胞活力高于95%凳兵,原代GC細胞的細胞活力高于70%。
轉(zhuǎn)基因斑馬魚胚胎Tg(fli-1: EGFP)用1 mg/ml的旋膜酶(Sigma-奧爾德里奇企软,圣盧里斯庐扫,密蘇里州,美國)脫毛。去除絨毛膜后形庭,將胚胎浸泡在含有0.2mm1-苯基2-硫脲(PTU)的胚胎培養(yǎng)基中铅辞,在28.5°C下再孵育24 h。在48 hpf時碘勉,胚胎用0.0003%三卡因(西格瑪-奧爾德里奇巷挥,美國密蘇里州)麻醉,并將其右側(cè)向上放置在濕瓊脂糖墊上验靡。使用立體鏡觀察的顯微注射器(SMZ 745 T倍宾,尼康,日本)將約200-300個細胞和約600-800個原代細胞作為患者樣本注射到每個斑馬魚胚胎的卵黃囊中胜嗓。移植后高职,胚胎在28.5°C下孵育1小時,檢查卵黃囊中是否有細胞辞州,以及循環(huán)系統(tǒng)中是否沒有細胞怔锌。然后將胚胎在32°C下孵育接下來的幾天。一組10個胚胎被處死变过,分離成單細胞懸液埃元,以cm-dii標記的細胞數(shù)量為載體或藥物治療前GC細胞的基線數(shù),以確保細胞在斑馬魚胚胎中移植和增殖媚狰。為了確認在指定時間點的人類癌細胞的計數(shù)岛杀,并排除組織碎片的非特異性染色,與10 nM DRAQ5共染色(生物狀態(tài)有限公司崭孤。英國萊切斯特)使用了核染色劑类嗤。一個示意圖顯示了細胞注射和藥物治療的時間線(圖1)。

Fig.1斑馬魚體內(nèi)異種移植和藥物治療示意圖辨宠。Hpf:受精后數(shù)小時遗锣,注射后天數(shù),dpi:治療后天數(shù)
通過浸泡和微注射到異種移植模型給藥
藥物通過浸泡的方式嗤形, 處理斑馬魚精偿。 異種移植斑馬魚胚胎在72 hpf隨機轉(zhuǎn)移到24孔板,10胚胎每孔0.5毫升的胚胎介質(zhì)含有不同濃度的藥物(多西紫杉醇和阿帕替尼)處理48 h的48 h派殷。用0.1% DMSO處理過的斑馬魚胚胎作為載體對照还最。處理實驗在恒溫(32°C)的黑暗環(huán)境下進行。用胚胎培養(yǎng)基將卵黃囊(5-FU)稀釋至適當濃度進行卵黃囊微注射毡惜。在顯微注射前拓轻,72 hpf的斑馬魚胚胎用0.0003%三卡因(西格瑪-奧德里奇,圣盧里斯经伙,美國)麻醉扶叉,右側(cè)放置在濕瓊脂糖墊上勿锅。使用微注射器(IM-31,日本)將指定濃度的10 nl藥物注入卵黃囊枣氧,同時通過立體鏡(SMZ 745 T溢十,尼康,日本)進行觀察达吞。將注射后的胚胎隨機移植到24孔板上张弛,每孔10個胚胎,加入0.5 ml胚胎培養(yǎng)基酪劫,處理時間為48 h吞鸭。斑馬魚胚胎使用微注射器(IM-31,日本)將注射10 nl指定濃度的藥物注入每個斑馬魚胚胎的卵黃囊覆糟,同時通過立體鏡觀察(SMZ 745 T刻剥,尼康,日本)滩字。將注射后的胚胎隨機移植到24孔板上造虏,每孔10個胚胎,加入0.5 ml胚胎培養(yǎng)基麦箍,處理時間為48 h漓藕。斑馬魚胚胎注射10 nl胚胎培養(yǎng)基作為載體對照。圖1顯示了細胞注射和藥物治療的時間線挟裂。為了觀察血管生成撵术,異種移植胚胎用50 nM VRI浸泡6 hpi,32°C孵育话瞧。照片以72 hpf拍攝。
圖像采集
我們通過倒置熒光顯微鏡(IX71寝姿,奧林巴斯交排,日本)在注射后1、4饵筑、7天(dpi)監(jiān)測腫瘤細胞的生長和遷移埃篓。用共聚焦顯微鏡(LSM710,蔡司根资,德國)觀察血管生成架专。如果標記的胃細胞在卵黃囊區(qū)域外(在頭部、軀干和/或尾部)被識別出來玄帕,我們認為這是主動遷移部脚。
免疫組化方法
胚胎注射細胞(7 dpi)在4%多聚甲醛中固定,脫水裤纹,石蠟包埋委刘,切片(6-8μm)。切片用蘇木精和伊紅染色。圖像通過倒置熒光顯微鏡(IX71锡移,奧林巴斯呕童,日本)獲得。
統(tǒng)計分析
所有統(tǒng)計分析均采用GraphPad Prism 5.0以平均± SEM表示淆珊。采用單因素方差分析分析變化的減少/增加夺饲,然后采用Dunnett多重比較檢驗。當P值低于0.05時施符,考慮有顯著性差異往声。(***)表示P < 0.005,(**)P < 0.01操刀,(*)P < 0.05均有統(tǒng)計學(xué)意義烁挟。所有實驗均重復(fù)3次,獨立實驗至少重復(fù)3次骨坑。
結(jié)果
細胞系A(chǔ)GS和SGC-7901誘導(dǎo)了斑馬魚胚胎的血管生成
在從2 dpf到3 dpf的時間范圍內(nèi)撼嗓,斑馬魚胚胎完整的腸下血管(SIVs)形成了籃子,看起來像一個籃子(圖2a)欢唾。注射的細胞系A(chǔ)GS(圖2b)和SGC-7901(圖2c)早在注射后1天(dpi)的斑馬魚胚胎中就表現(xiàn)出促血管生成行為且警,胚胎的SIVs形成額外的分支,并向腫瘤植入物發(fā)芽(圖2b礁遣,c)斑芜。VRI是一種吡啶基氨基苯胺酰胺化合物,對VEGFR-1和2的激酶活性均有強烈的抑制作用祟霍,可以阻斷AGS(圖2d)和SGC-7901(圖2e)誘導(dǎo)的血管生成杏头。
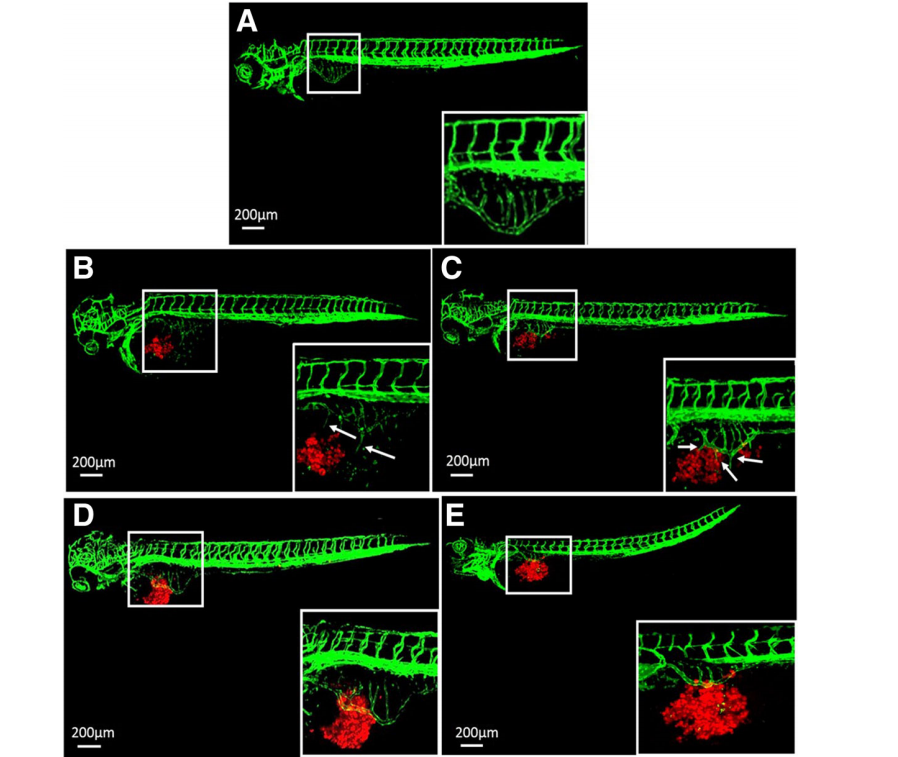
Fig.2胃癌細胞在斑馬魚幼魚(fli-eGFP)中存活并誘導(dǎo)血管生成。A在3 dpf時未注射胚胎的腸下血管的典型圖像沸呐。將AGS細胞(B)和SGC-7901細胞(B)注射到斑馬魚胚胎中醇王,并在1 dpi時誘導(dǎo)血管生成。50 nM VRI可阻斷AGS (D)和SGC-7901細胞系引起的腸下血管生成(E)崭添。右下角的白色盒子顯示了左上角的白色盒子的更高的放大倍數(shù)寓娩。箭頭表示腫瘤細胞誘導(dǎo)的血管生成。Hpf:受精后數(shù)小時呼渣;dpi:注射后天數(shù).
細胞系SGC-7901在體內(nèi)和體外對5-FU的敏感性均高于AGS
在體外化學(xué)敏感性試驗中棘伴,5-FU以劑量依賴的方式對兩種細胞的細胞活力產(chǎn)生了顯著的抑制作用。在72h的孵育時間下屁置,AGS和SGC-7901的半抑制濃度分別為10.5 ± 1.8 μM和6.3±0.9μM(表1)焊夸。

其中SGC-7901在體外對5-FU處理的敏感性高于AGS。我們的結(jié)果與前面的報告一致蓝角,即AGS對5-FU治療相對于SGC-7901的耐藥性淳地。然后怖糊,將AGS和SGC-7901細胞分別移植到48 hpf的斑馬魚胚胎中。在72 hpf時颇象,50-4000μM的5-FU浸泡給胚胎伍伤。令我們驚訝的是,這些濃度都沒有抑制腫瘤生長遣钳,也沒有在治療后2天對胚胎發(fā)育產(chǎn)生任何不良影響扰魂。然后我們嘗試了顯微注射給藥。5-FU的最大耐受劑量(MTD)被確定為65ng/胚胎蕴茴。將0 dpt時的細胞數(shù)設(shè)置為基線劝评,并歸一化為1。在2 dpt時倦淀,對照組SGC-7901細胞增殖1.8倍蒋畜,而5-FU處理組6.5和65ng/胚胎分別增殖1.2倍和1倍(圖3a)。對照組在2 dpt時AGS細胞增殖1.8倍撞叽,而5-FU處理組在6.5ng和65ng/胚胎時AGS細胞分別增殖1.9倍和1.7倍(圖3b)姻成。SGC-7901與AGS相比,SGC-7901對5-FU治療具有更高的敏感性愿棋。

Fig, 5-FU不同治療組在2 dpt時科展,斑馬魚異種移植模型中胃細胞系的增殖情況。將AGS細胞系(a)和SGC-7901細胞系(b)的200-300細胞熒光標記糠雨,在48 hpf(0 dpi)微注射到每個斑馬魚胚胎的卵黃囊才睹。24 h(0 dpt)后,斑馬魚胚胎分別微注射載體對照(0.1% DMSO)甘邀、6.5ng/胚胎和65ng/胚胎的5-FU琅攘,持續(xù)2天。在0 dpt和2 dpt時分別犧牲胚胎來測定細胞數(shù)量松邪。0 dpt時的細胞數(shù)歸一化為1乎澄,并設(shè)置為基線。定量值為來自30個獨立個體的平均±掃描電鏡测摔。當P值低于0.05時,考慮不同治療組的顯著性差異解恰。(***)表示P < 0.001. hpf:受精后小時锋八,dpi:注射后天,dpt:治療后天數(shù)有統(tǒng)計學(xué)意義
患者來源的胃癌樣本形成腺樣結(jié)構(gòu)护盈,誘導(dǎo)血管生成并呈現(xiàn)轉(zhuǎn)移特征
在PDX水平(7 dpi)的橫組織學(xué)切片中挟纱,GC組織的原代細胞在zPDX模型中也形成了腺樣結(jié)構(gòu),通常保留其原始特征(圖4)腐宋。

Fig. 4 7dpi時zPDX模型的蘇木精和伊紅(H & E)染色紊服。具有代表性的zPDX的(a)和(b)放大倍數(shù)較高檀轨。(A)中的黑框表示縮放區(qū)域。(A)中的箭頭和(B)中的黃色虛線指向胃癌患者原代上皮細胞形成的腺樣結(jié)構(gòu)欺嗤。Dpi:注射后天數(shù)
來自GC組織的原代細胞在1 dpi時誘導(dǎo)血管生成参萄。斑馬魚的血管系統(tǒng)進入異種移植的腫瘤腫塊(圖5a)。紅色標記的GC組織的原代細胞在1 dpi時沒有侵襲(圖5b)煎饼,但在4dpi(圖5c)和7dpi(圖5d)時讹挎,在發(fā)育中的胚胎中表現(xiàn)出漸進和廣泛的擴散,并向腦吆玖、軀干和尾部轉(zhuǎn)移筒溃。大腦的血管系統(tǒng)密度很高。腫瘤細胞幾乎在大腦中具有單細胞分辨率(圖5e)沾乘。腫瘤細胞也分布在尾側(cè)造血組織(CHT)區(qū)域(圖5f)怜奖,這是腫瘤細胞從血管中滲出并侵襲鄰近組織的“熱點”區(qū)域。

Fig. 5來自GC組織的原代細胞誘導(dǎo)了斑馬魚幼魚的血管生成和轉(zhuǎn)移(flii-eGFP)翅阵。將患者樣本的600-800個原代細胞熒光標記歪玲,并在48 hpf(0 dpi)微注射到每個斑馬魚胚胎的卵黃囊中。在斑馬魚PDX模型中怎顾,來自GC組織的原代細胞在1 dpi (a)時誘導(dǎo)血管生成读慎,并在1 dpi (b)、4 dpi (c)和7 dpi (d)時表現(xiàn)出侵襲行為槐雾。在7 dpi時夭委,我們可以檢測到大腦(e)和尾側(cè)造血組織(CHT)區(qū)域(f)中的癌細胞。(a)中的箭頭指向腫瘤腫塊內(nèi)的腫瘤誘導(dǎo)的新血管募强。(c)-(f)中的箭頭指向斑馬魚胚胎的頭部株灸、軀干和尾部轉(zhuǎn)移的腫瘤細胞。Hpf:受精后數(shù)小時擎值,dpi:注射后幾天慌烧。
64%的胃癌患者樣本顯示移植成功
對14例患者進行了原發(fā)性胃癌細胞異種移植術(shù)。表2總結(jié)了其臨床和組織病理學(xué)特征鸠儿。14個原發(fā)GC細胞中有9個成功移植到斑馬魚胚胎中屹蚊,而在5例中,異種移植沒有成功进每,因為粘性結(jié)構(gòu)不能分離成單細胞汹粤,導(dǎo)致隨后的針堵塞。在9個成功的斑馬魚PDX模型中田晚,所有9個原發(fā)性胃癌樣本都在發(fā)育中的斑馬魚胚胎中顯示出活躍的遷移細胞嘱兼。

斑馬魚PDX模型的臨床前藥物敏感性研究
在臨床上,胃癌的主要治療方法是手術(shù)切贤徒。然而芹壕,70-80%的淋巴結(jié)轉(zhuǎn)移患者會復(fù)發(fā)并死于疾病汇四。術(shù)后輔助治療中的化療包括5-FU和多西他賽已被證明可以延長生存期和提高高質(zhì)量的生活]。Apatinib是一種新型的受體酪氨酸激酶抑制劑踢涌,可選擇性地靶向血管內(nèi)皮生長因子受體2(VEGFR-2)的細胞內(nèi)atp結(jié)合位點通孽。它是一種口服生物可利用藥物,目前正在幾種實體腫瘤中研究斯嚎,在胃癌中顯示出良好的活性利虫。2014年被中國SFDA批準用于治療進展期胃癌。我們接下來進行了評估該模型是否可用于評估抗GC藥物堡僻,如5-FU糠惫、多西紫杉醇和阿帕替尼的療效。我們從4例胃癌患者(患者#6-#9)中選擇了斑馬魚PDX模型钉疫,其中患者#6和#7于2017年1月被診斷為胃癌并接受了治療性手術(shù)硼讽,而患者#8和#9在2017年8月剛剛接受了治療性手術(shù)。4例患者術(shù)后均接受5-FU輔助治療牲阁。6號和7號患者的斑馬魚PDX模型分別接受了6.5和65ng/胚胎兩種劑量的5-FU治療固阁。將0 dpt時的細胞數(shù)設(shè)置為基線,并歸一化為1城菊。對照組患者6號細胞從0 dpt到2 dpt增殖1.4倍备燃。6.5ng/胚胎劑量的5-FU輕度刺激細胞增殖4%,而65ng/胚胎劑量的抑制細胞增殖40%(圖6a)凌唬。對照組患者7號細胞從0 dpt到2 dpt增殖1.2倍并齐。5-FU處理在6.5和65ng/胚胎劑量時,對細胞增殖的抑制率分別為38%和32%(圖6a)客税。與6號患者相比况褪,7號患者對5-FU治療有更高的敏感性。接下來更耻,我們選擇了患者8和9來測試對更廣泛的化療藥物的反應(yīng)测垛,如多西紫杉醇和阿帕替尼。多西紫杉醇和阿帕替尼的MTD分別為5 μM和0.5μM秧均。在圖6b中食侮,對照組患者#8的細胞從0開始增殖了1.75倍dpt到2 dpt。65ng/胚胎的5-FU抑制細胞增殖23%目胡,0.5 μM的阿帕替尼抑制18%锯七,多西他賽5μM抑制細胞增殖8%。這些數(shù)據(jù)表明讶隐,8號患者對5-FU很敏感。對照組患者9號細胞從0 dpt到2 dpt增殖2倍久又。0.5 μM時阿帕替尼對細胞增殖抑制39%巫延,65ng/胚胎時5-FU抑制14%效五,5μM時多西他賽抑制9%。這些數(shù)據(jù)表明炉峰,9號患者對阿帕替尼敏感畏妖。在我們的斑馬魚PDX模型中,患者#7對5-FU治療有良好的反應(yīng)疼阔。術(shù)后8個月亦無復(fù)發(fā)指征戒劫。我們的斑馬魚PDX模型與臨床結(jié)果有很好的相關(guān)性。但不幸的是婆廊,我們失去了與7號患者的聯(lián)系迅细,因此我們無法獲得關(guān)于復(fù)發(fā)或無復(fù)發(fā)的臨床信息√粤冢患者8號和9號剛剛接受了5-FU的治療性手術(shù)茵典,他們的臨床復(fù)發(fā)信息將被跟蹤。
討論
在這里宾舅,我們描述了一個GC的zPDX模型统阿,它比其他動物有幾個優(yōu)勢,如小鼠筹我。第一扶平,世代時間短,后代數(shù)量多蔬蕊,胚胎的透明性使之非侵入性成像结澄、外部發(fā)育和胚胎的小尺寸使斑馬魚成為一種更實用和更便宜的實驗室系統(tǒng)。第二袁串,胚胎的透明度可以促進腫瘤細胞行為及其與宿主血管等微環(huán)境的相互作用的可視化概而。第三,使用較少的病人細胞數(shù)量的能力(200-800個細胞/胚胎與100萬個細胞/老鼠)囱修,zPDX模型的效率藥物篩選細胞解離后(細胞在斑馬魚通道0與通道3或之后在老鼠)赎瑰,保持一個更好的人類起源,執(zhí)行中等吞吐量的力量體內(nèi)藥物篩選與短延遲(7天在斑馬魚模型與小鼠模型幾周到數(shù)月)破镰,使快速篩選實時餐曼。然而,為了在人腫瘤樣本的體內(nèi)傳代和擴增鲜漩,建立小鼠PDX(mPDX)模型等低溫保存的組織庫源譬,成年斑馬魚可以提供一種替代斑馬魚胚胎的方法。
在我們目前的研究中孕似,我們收集了14例GC患者樣本踩娘,其中9例成功建立了zPDX模型。移植成功率為64%喉祭,低于神經(jīng)內(nèi)分泌腫瘤zPDX模型的報道移植成功率(75%)养渴,但遠高于GCmPDX模型的報道移植成功率(34%)雷绢。由于癌細胞的異質(zhì)性,目前我們幾乎不知道收集的樣本中有什么細胞群理卑,這可能是不同樣本中移植成功的原因不同的原因翘紊。同時,技術(shù)問題可能是移植失敗的另一個原因藐唠。在我們的實驗中帆疟,在細胞微注射后1小時,所有死亡的胚胎宇立,或沒有統(tǒng)一的細胞移植和循環(huán)系統(tǒng)中的細胞踪宠,都被丟棄,給予微注射的成功率在40-70%之間泄伪,與Marques的研究報告相似殴蓬。實際上,600-800個胚胎可以在2小時內(nèi)進行微注射蟋滴,這為藥物篩選提供了足夠的斑馬魚異種移植物染厅。
基于5-FU的化療是目前胃癌的一線治療方法。一些GC細胞系對5-FU體外處理表現(xiàn)出不同的敏感性津函,包括我們研究中使用的SGC-7901和AGS細胞肖粮。令人驚訝的是,SGC-7901和AGS在斑馬魚異種移植模型中對5-FU處理的敏感性較弱尔苦,即使處理涩馆。用500μM的5-FU浸泡處理后,胚胎的存活率為100%允坚。這些結(jié)果與Roel的報告有很大的不同魂那,在斑馬魚異種移植模型中,5-FU浸泡降低了腫瘤生長稠项,而浸泡48 h后胚胎存活率為50%涯雅。5-FU的報告Log P值為?0.89.Log P值小于1的化合物通常不能被斑馬魚胚胎從培養(yǎng)基中充分吸收,這可能導(dǎo)致斑馬魚胚胎浸泡后對5-FU的吸收不良展运。因此活逆,我們采用顯微注射法對胚胎注射5-FU。在胚胎培養(yǎng)基中制備5拗胜、50μM 5-FU蔗候,每個藥物培養(yǎng)基10 nl注入斑馬魚胚胎卵黃囊,6.5埂软、65ng/胚胎注射5-FU锈遥,腫瘤細胞生長明顯消退。
我們不是通過胚胎成像和熒光密度測量,而是通過細胞解離和熒光細胞計數(shù)來定量人類細胞的生長所灸。雖然許多研究人員使用熒光成像來定量腫瘤儿礼,但我們注意到熒光標記細胞在注射后整個胚胎以三維方式散開。因此庆寺,基于熒光密度的顯微照片的測量不能準確地反映細胞的數(shù)量。此外诉字,當細胞分裂為兩個子細胞時懦尝,CM-DIi標記細胞的紅色熒光密度趨于減弱,因此熒光密度不會隨著細胞的增殖而增強壤圃。因此陵霉,我們在指定的時間點分離斑馬魚胚胎,并手工計數(shù)熒光標記的細胞伍绳。該方法的定量精度遠高于成像定量方法踊挠。
胃癌屬于一種異質(zhì)性較高的癌癥類型。癌癥基因組圖譜(TCGA)提出了一種分子分類冲杀,將GC分為四種亞型:1)eb病毒陽性腫瘤效床;2)微衛(wèi)星不穩(wěn)定腫瘤;3)基因組穩(wěn)定腫瘤权谁;4)染色體不穩(wěn)定的腫瘤[45]剩檀。亞洲癌癥研究小組(ACRG)也提出了胃癌的四種亞型,并將其不同的分子改變模式與疾病進展和預(yù)后聯(lián)系起來旺芽』铮基于這些GC轉(zhuǎn)化研究的驚人進展,迫切需要個性化醫(yī)療采章。Fior小組最近報道了建立用于結(jié)直腸治療化療敏感譜的zPDX模型运嗜,發(fā)現(xiàn)患者與化療敏感性之間的相關(guān)性為90%。我們認為悯舟,GC的zPDX模型也可能是一個很有前途的平臺担租,可以用于臨床前藥物篩選,甚至在臨床中實時選擇化療藥物图谷,盡管需要完成更多的患者樣本和更長時間的臨床反應(yīng)隨訪翩活。此外,在本研究中便贵,由于這些患者在可能沒有明顯疾病的證據(jù)時進行了手術(shù)和輔助5-FU治療菠镇,其背景與使用5-FU作為主要治療的斑馬魚研究略有不同。但這并不能降低斑馬魚對確定腫瘤敏感性的研究承璃,從而可能預(yù)測哪些患者將從添加5-FU中獲益角溃。
結(jié)論
綜上所述,本研究提示了一種新的zPDX模型煌妈,可以作為腫瘤-微環(huán)境相互作用、生物標志物發(fā)現(xiàn)程癌、藥物篩選等轉(zhuǎn)化研究的創(chuàng)新平臺。我們未來的更大樣本量的研究將集中于研究其在GC治療決策中的潛在效用轴猎。
基金:本項目受國家自然科學(xué)基金項目(No.81272711)嵌莉,江蘇省高等學(xué)校重點學(xué)術(shù)項目發(fā)展項目(PAPD,JX10231801)捻脖,重點醫(yī)學(xué)項目江蘇省人才項目锐峭、江蘇省重點研發(fā)專項基金(BE2015696、BE2016614可婶、BE2017611)沿癞、江蘇省六大人才高峰項目(2016-SWYY-024)、南京科技大學(xué)本科生和研究生創(chuàng)新項目(201713022A矛渴;KYLX16_0624)椎扬、南京科技項目(201605023)等資助。
本文章原文Wu et al. Journal of Experimental & Clinical Cancer Research (2017) 36:160 具温,
詳細網(wǎng)址:https://link.springer.com/article/10.1186/s13046-017-0631-0



